
Merck KGaA: EU-Ausschuss empfiehlt Avelumab zur Zulassung bei seltenem Hautkrebs
DARMSTADT (dpa-AFX) - Der Darmstädter Pharma- und Chemiekonzern Merck
Die Europäische Kommission muss nun über die Zulassung entscheiden. Diese soll im dritten Quartal fallen. Merck entwickelt Avelumab zusammen mit dem US-Konzern Pfizer
ARIVA.DE Börsen-Geflüster
Weiter aufwärts?
| Kurzfristig positionieren in Merck KGaA | ||
|
VP7TJQ
| Ask: 2,90 | Hebel: 4,49 |
| mit moderatem Hebel |
Zum Produkt
| |

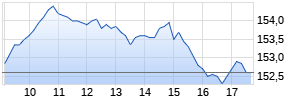
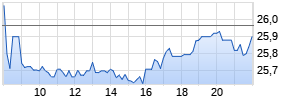
Kurse
 |
 |
Mehr Nachrichten zur Pfizer Inc. Aktie kostenlos abonnieren
(Mit der Bestellung akzeptierst du die Datenschutzhinweise)

Hinweis: ARIVA.DE veröffentlicht in dieser Rubrik Analysen, Kolumnen und Nachrichten aus verschiedenen Quellen. Die ARIVA.DE AG ist nicht verantwortlich für Inhalte, die erkennbar von Dritten in den „News“-Bereich dieser Webseite eingestellt worden sind, und macht sich diese nicht zu Eigen. Diese Inhalte sind insbesondere durch eine entsprechende „von“-Kennzeichnung unterhalb der Artikelüberschrift und/oder durch den Link „Um den vollständigen Artikel zu lesen, klicken Sie bitte hier.“ erkennbar; verantwortlich für diese Inhalte ist allein der genannte Dritte.



